在肿瘤学研究的道路上,科学家们不断探索新的技术和方法,以期能够更深入地理解肿瘤的发生、发展和治疗。今天,我们要向大家介绍近年来在肿瘤研究中崭露头角的先进技术——组织成像质谱流式系统。
一、什么是组织成像质谱流式系统?
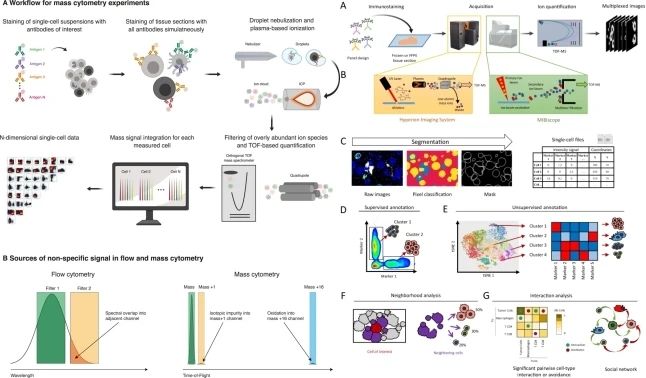
Hyperion组织成像质谱流式系统由Helios质谱流式系统(CyTOF)和Hyperion成像模块(IMC)共同组成,可以对单细胞悬液样本和组织切片样本进行多参数蛋白检测。CyTOF结合了流式细胞仪和质谱仪的先进技术,能够对单个细胞进行高通量的蛋白质组学分析。而IMC则结合了质谱成像和流式细胞仪的优势,能够在组织切片上实现高通量的蛋白质组学分析。这两种技术的结合,为肿瘤研究提供了前所未有的洞察力。
图1. 质谱流式(CyTOF)与组织成像质谱流式(IMC)技术工作流程图【1-2】
二、组织成像质谱流式系统技术优势
1. 多参数分析能力:质谱流式细胞术可以使用多达40多种金属同位素作为标记,允许同时对细胞表面和细胞内的多种标记物进行分析,而传统流式细胞术通常受限于可用的荧光标签数量,一般不超过20个。
2. 节省样本:真正的单管实验,仅需1管样本可同时检测40多种标志物,用少量的样本挖掘出更多有用的信息。
3. 高分辨率、灵敏度和无串色问题:质谱流式细胞术利用ICP质谱技术进行检测,能够以极高的分辨率区分不同的金属同位素标记,从而避免了荧光标记中常见的串色问题,使得相邻通道间的干扰极低,无需进行复杂的计算补偿。
4. 组织成像能力:质谱流式成像系统能够实现亚细胞水平的组织成像,为组织微环境的研究提供了新的视角。
这些优势使得质谱流式细胞术在肿瘤研究领域中具有重要的应用价值,特别是在单细胞水平的多参数分析、药物靶标发现、以及精准医学等方面展现出其独特的潜力。
三、组织成像质谱流式系统在肿瘤学研究中的应用
1. 肿瘤标志物发现:通过CyTOF和IMC技术,科学家们能够检测和分析肿瘤细胞中的蛋白质表达,从而发现新的肿瘤标志物。这些标志物对于肿瘤的早期诊断、治疗和预后评估具有重要意义【3-4】。
2. 肿瘤分型与分期:CyTOF和IMC技术可以对肿瘤细胞进行更精确的分类和分期。这有助于制定更个性化的治疗方案,提高治疗效果【5-6】。
3. 肿瘤微环境分析:IMC技术能够揭示肿瘤组织内部的微环境特征,包括细胞类型、分布以及细胞间的相互作用。这些信息对于理解肿瘤的发生、发展和转移具有重要意义【7-8】。
4. 药物疗效评估:通过CyTOF和IMC技术,科学家们可以评估药物在肿瘤组织中的分布和疗效。这为药物研发和优化提供了重要依据【9-10】。
四、技术结合带来的新突破
当CyTOF和IMC技术结合使用时,它们能够为我们提供更全面的肿瘤研究解决方案。通过这两种技术的结合,我们能够在细胞和分子层面上更深入地了解肿瘤的发生、发展和转移机制,为肿瘤的诊断、治疗和预防提供更有力的支持。
参考文献:
[1] Glasson Y, Chépeaux L A, Dumé A S, et al. Single-cell high-dimensional imaging mass cytometry: one step beyond in oncology. Semin Immunopathol, 2023, 45(1): 17-28.
[2] Rigamonti A, Viatore M, Polidori R, et al. Integrating AI-Powered Digital Pathology and Imaging Mass Cytometry Identifies Key Classifiers of Tumor Cells, Stroma, and Immune Cells in Non-Small Cell Lung Cancer. Cancer Res, 2024, 84(7): 1165-1177.
[3] Zhang Q, Ye M, Lin C, et al. Mass cytometry-based peripheral blood analysis as a novel tool for early detection of solid tumours: a multicentre study. Gut, 2023, 72(5): 996-1006.
[4] Barsch M, Salié H, Schlaak A E, et al. T-cell exhaustion and residency dynamics inform clinical outcomes in hepatocellular carcinoma. J Hepatol, 2022, 77(2): 397-409.
[5] Ali H R, Jackson H W, Zanotelli V R T, et al. Imaging mass cytometry and multiplatform genomics define the phenogenomic landscape of breast cancer. Nat Cancer, 2020, 1(2): 163-175.
[6] Liu X, Tang R, Xu J, et al. CRIP1 fosters MDSC trafficking and resets tumour microenvironment via facilitating NF-κB/p65 nuclear translocation in pancreatic ductal adenocarcinoma. Gut, 2023, 72(12): 2329-2343.
[7] Zabransky D J, Danilova L, Leatherman J M, et al. Profiling of syngeneic mouse HCC tumor models as a framework to understand anti-PD-1 sensitive tumor microenvironments. Hepatology, 2023, 77(5): 1566-1579.
[8] Georgopoulou D, Callari M, Rueda O M, et al. Landscapes of cellular phenotypic diversity in breast cancer xenografts and their impact on drug response. Nat Commun, 2021, 12(1): 1998.
[9] Zhu C, Shi Y, Li Q, et al. Rational administration sequencing of immunochemotherapy elicits powerful anti-tumor effect. J Control Release, 2022, 341: 769-781.
[10] Ramos Zapatero M, Tong A, Opzoomer J W, et al. Trellis tree-based analysis reveals stromal regulation of patient-derived organoid drug responses. Cell, 2023, 186(25): 5606-5619.e5624.



 关闭
关闭