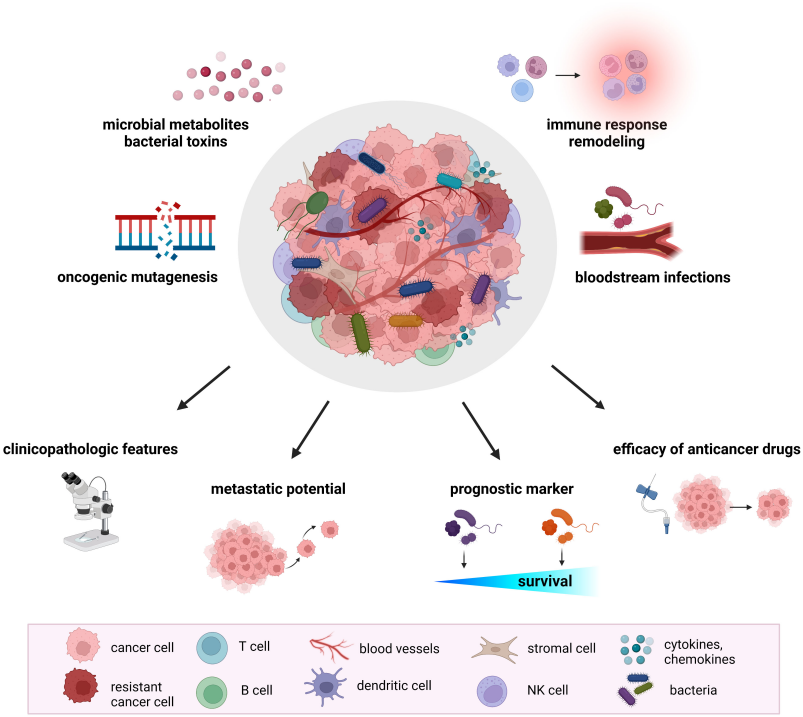
肿瘤微环境是一个复杂的生态系统,除肿瘤细胞外,还包含许多其他细胞、血管和细胞外基质。对肿瘤发生发展到以及对治疗的耐受性或敏感性产生深刻影响。如今,肿瘤相关微生物群也已成为其中全新的重要组成部分。
图1:肿瘤微生物群在癌症发展和治疗中的作用
(图源:Ciernikova S. Tumor microbiome - an integral part of the tumor microenvironment. Front Oncol. 2022)
肿瘤相关微生物的历史发展
人类将肿瘤和微生物联系起来的历史可追溯到四千年多前。艾伯斯草纸书(Ebers Papyrus)记载了古埃及医生Imhotep切开患处导致感染,从而治疗肿瘤的方法[1]。细菌病原学说确立后,19世纪末,Wilhelm Busch和Friedrich Fehleisen首次报道了化脓性链球菌感染患者的肿瘤自发消退[2]。
然而,由于微生物量低,实验环境污染和生物毒性等原因,过去的一个多世纪里,相关研究结果的可信度一直备受争议。直到最近,随着测序、动物模型、核酸富集和污染消除等技术的进步,微生物群在肿瘤形成、诊治和预后中的作用的影响才受到承认和重视,成为一个快速发展的领域。
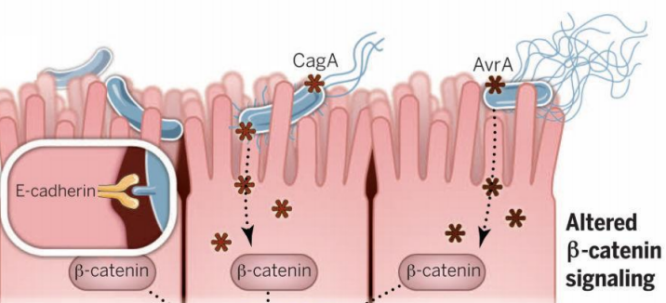
细菌驱动肿瘤形成
除了国际癌症研究机构(IACR)已经确定10种的致癌微生物[3],其他微生物尤其是细菌还可以通过基因毒素如大肠杆菌素(DNA烷基化剂)[4],细胞致死扩张毒素(CDT;DNAse活性)[5]和脆弱拟杆菌毒素(Bft;诱导高水平的ROS)[6]介导突变;或是表达蛋白质如幽门螺杆菌表达CagA [7]和具核梭杆菌表达FadA[8](Wnt/β-Catenin通路)上调参与细胞增殖、迁移和血管生成的基因。
图2:细菌通过诱导突变或调节信号通路促进肿瘤形成
(图源:Garrett WS. Cancer and the microbiota. Science. 2015)
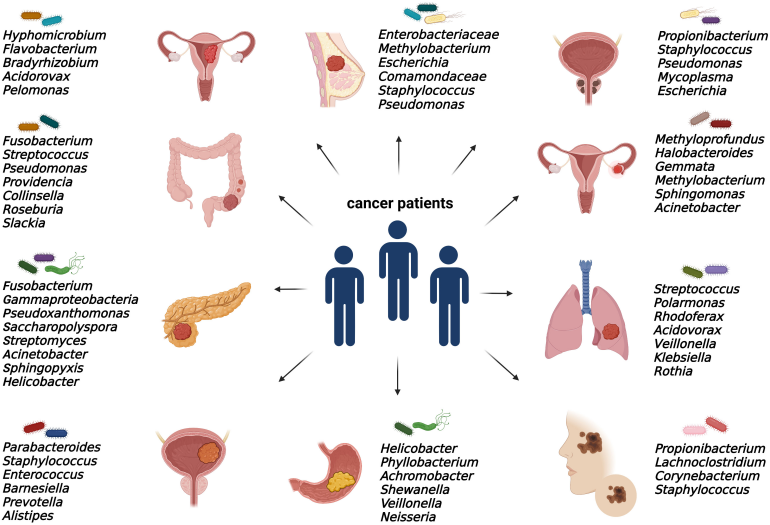
2020年,Nejman等人对胶质母细胞瘤、乳腺癌、卵巢癌、骨肉瘤、胰腺癌、黑色素瘤和肺癌等7种肿瘤的微生物组进行了分析,都发现了主要位于肿瘤细胞和免疫细胞中且有生物活性的细菌。菌群具有肿瘤类型特异性,每个亚型都有一个独特的具有特定代谢功能的细菌群落[9]。
图3:在不同类肿瘤组织中发现的细菌种属
(图源:Ciernikova S. Tumor microbiome - an integral part of the tumor microenvironment. Front Oncol. 2022)
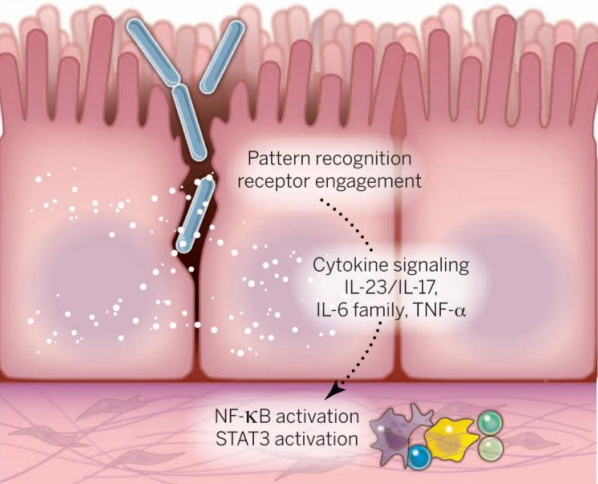
细菌抑制抗肿瘤免疫
细菌在调节宿主免疫反应中也发挥重要作用,通过改变稳态和诱发慢性炎症,导致组织破坏和免疫反应失调。Pushalkar等人在胰腺癌中发现瘤内细菌能引起TAM表面的TLR高表达,向M2亚型极化,上调抑制性细胞因子表达[10],从而增加肿瘤的整体免疫耐受,抑制宿主的的抗肿瘤免疫反应。
图4:瘤内细菌对抗肿瘤免疫的抑制作用
(图源:Garrett WS. Cancer and the microbiota. Science. 2015)
细菌促进肿瘤转移
一系列最新的研究成果显示:瘤内细菌的丰度差异与肿瘤的组织类型、分期、分级、侵袭等病理特征和转移潜能存在明显联系[11]。在乳腺癌中高丰度的卟啉单胞菌属、乳酸杆菌属和梭杆菌属与较高的肿瘤分期相关;而低丰度的的微球菌属、茎杆菌属、变形杆菌属和短芽孢杆菌属与雌激素受体阳性相关。其中具核梭杆菌通过重组肿瘤细胞内的肌动蛋白细胞骨架网络,促进了乳腺癌的生长和转移[12]。
细菌抑制肿瘤治疗
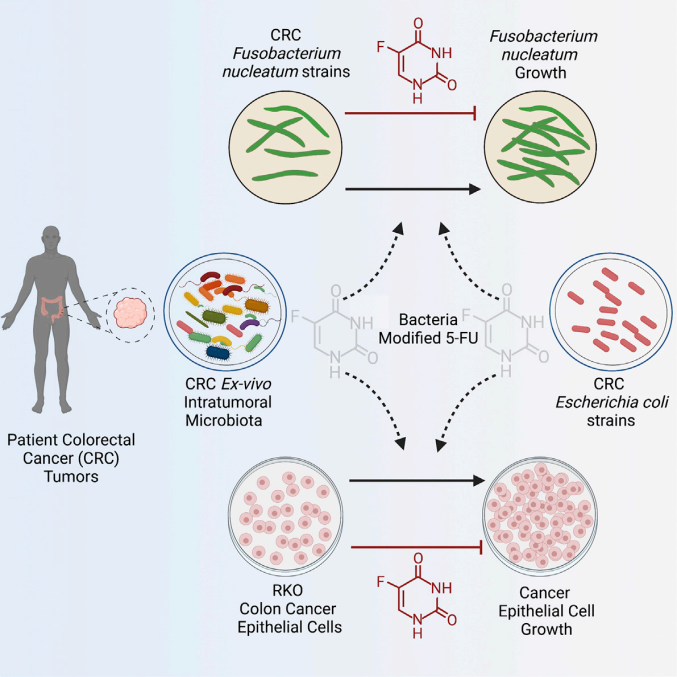
一部分细菌还拥有耐受、降解化疗药物的能力。例如,具核梭杆菌介导TLR4-MyD88通路进行的自噬调节与肿瘤对Oxaliplatin和5-FU的耐药性存在联系[12];结直肠癌和胰腺癌中的肠杆菌和假单胞菌能通过表达细菌胞苷脱氨酶分别将5-FU和Gemcitabine代谢为无毒产物,失去治疗作用[13]。
图5:细菌代谢的5-FU不再抑制肿瘤的生长
(图源:LaCourse KD. The cancer chemotherapeutic 5-fluorouracil is a potent Fusobacterium nucleatum inhibitor and its activity is modified by intratumoral microbiota. Cell Rep. 2022)
未来的展望
一方面,瘤内细菌种属、丰度、定位的不同,可能引起抗肿瘤治疗效果的显著差异,深入研究将有助于新的个性化疗法的开发,提高患者预后。另一方面,瘤内活菌的存在和细菌工程技术的进步提供了将特异修饰的细菌开发为抗肿瘤载体的可能性。此外,利用抗生素、粪菌移植等方式对肿瘤相关菌群的主动调控有望改善肿瘤的免疫微环境,提高抗肿瘤治疗的疗效。
在可预见的未来,对不同肿瘤微生物群的深入研究将为抗癌治疗打开新的大门。
图6:调节内源性癌症微生物群的各环节
(图源:Sepich-Poore GD. The microbiome and human cancer. Science. 2021)
参考文献
[1] Ebbell B, The Papyrus Ebers: the greatest Egyptian medical document (Levin & Munksgaard, 1937).
[2] Busch W, Aus der Sitzung der medicinischen Section vom 13 November 1867. Berl Klin Wochenschr. 5, 137 (1868).
[3] IARC Working Group on the Evaluation of Carcinogenic Risks to Humans, Biological agents. Volume 100 B. A review of human carcinogens. IARC Monogr. Eval. Carcinog. Risks Hum 100, 1–441 (2012).
[4] Wilson, Matthew R et al. “The human gut bacterial genotoxin colibactin alkylates DNA.” Science (New York, N.Y.) vol. 363,6428 (2019): eaar7785.
[5]He, Zhen et al. “Campylobacter jejuni promotes colorectal tumorigenesis through the action of cytolethal distending toxin.” Gut vol. 68,2 (2019): 289-300.
[6] Goodwin, Andrew C et al. “Polyamine catabolism contributes to enterotoxigenic Bacteroides fragilis-induced colon tumorigenesis.” Proceedings of the National Academy of Sciences of the United States of America vol. 108,37 (2011): 15354-9.
[7] Abreu, Maria T, and Richard M Peek Jr. “Gastrointestinal malignancy and the microbiome.” Gastroenterology vol. 146,6 (2014): 1534-1546.e3.
[8] Rubinstein, Mara Roxana et al. “Fusobacterium nucleatum promotes colorectal carcinogenesis by modulating E-cadherin/β-catenin signaling via its FadA adhesin.” Cell host & microbe vol. 14,2 (2013): 195-206.
[9] Livyatan, I., Nejman, D., Shental, N., & Straussman, R. (2020). Characterization of the human tumor microbiome reveals tumor-type specific intra-cellular bacteria. Oncoimmunology, 9(1), 1800957.
[10] Pushalkar, Smruti et al. “The Pancreatic Cancer Microbiome Promotes Oncogenesis by Induction of Innate and Adaptive Immune Suppression.” Cancer discovery vol. 8,4 (2018): 403-416.
[11]Urbaniak, Camilla et al. “The Microbiota of Breast Tissue and Its Association with Breast Cancer.” Applied and environmental microbiology vol. 82,16 5039-48. 29 Jul. 2016.
[12]Hadzega, Dominik et al. “Uncovering Microbial Composition in Human Breast Cancer Primary Tumour Tissue Using Transcriptomic RNA-seq.” International journal of molecular sciences vol. 22,16 9058. 22 Aug. 2021
[13] Yu, TaChung et al. “Fusobacterium nucleatum Promotes Chemoresistance to Colorectal Cancer by Modulating Autophagy.” Cell vol. 170,3 (2017): 548-563.e16.
[14] LaCourse, Kaitlyn D et al. “The cancer chemotherapeutic 5-fluorouracil is a potent Fusobacterium nucleatum inhibitor and its activity is modified by intratumoral microbiota.” Cell reports vol. 41,7 (2022): 111625.
(供稿:王建民 党源 刘文翰)





 关闭
关闭